Ein Virus mit zwei Gesichtern
Hepatitis E
Jeder fünfte Deutsche weist – meist unbemerkt – Antikörper gegen das Hepatitis-E-Virus (HEV) auf. Die Infektionsquelle ist häufig Schweinefleisch, das mit HEV vom Genotyp 3 kontaminiert ist. Die schon lange bekannten Genotypen 1 und 2 werden dagegen nur von Mensch zu Mensch übertragen und sind in Deutschland selten. In der Regel heilt die Krankheit rasch von selbst aus, doch für immunsupprimierte Patienten kann sie lebensbedrohlich sein.
Schlüsselwörter: Hepatitis E, Genotypisierung, reiseassoziierte und autochthone Form, Immunsuppression
Das Hepatitis-E-Virus ist bereits seit Anfang der 1980er-Jahre bekannt. In Indien waren wiederholt Ausbrüche fäkal-oral übertragener Hepatitis beobachtet worden, die weder dem Hepatitis-A-Virus (HAV) noch einem anderen Erreger kausal zugeordnet werden konnten. Die ultrastrukturelle Darstellung von HEV gelang dem russischen Virologen M. Balayan, nachdem er sich 1983 im Selbstversuch infiziert hatte[1]. Das mit ca. 33 nm Durchmesser sehr kleine, unbehüllte Virus ähnelte dem damals bereits bekannten umweltstabilen HAV. Die vollständige Klonierung des einzelsträngigen RNA-Genoms gelang im Jahre 1991. In den Jahren danach folgten Berichte v. a. aus Indien, die eine hohe Sterblichkeit von 20–30% dokumentierten, wenn eine Hepatitis E während der Schwangerschaft aufgetreten war.
E wie „exotisch“?
In Deutschland galt die Hepatitis E seitdem als exotische Erkrankung, die von Reisenden aus Asien oder Afrika mitgebracht wird. Die meisten Ärzte schlossen sie bereits aus, wenn im Gespräch mit den Patienten keine Auslandsreise vorkam. Inzwischen ist jedoch bekannt, dass sich jedes Jahr schätzungsweise 300.000 Menschen in Deutschland mit HEV infizieren.
Etwa jeder fünfte hat spezifische Antikörper im Blut, die eine abgelaufene HEV-Infektion anzeigen[2]. Am häufigsten infizieren sich die Menschen vermutlich durch den Verzehr von kontaminierten Schweinefleischprodukten, die nicht ausreichend hoch und lange erhitzt wurden (z. B. Mett). Auch Roh- und Leberwürste kommen als Infektionsquelle infrage. Kürzlich wiesen Forscher vom Bundesinstitut für Risikobewertung in etwa jeder fünften untersuchten Leberwurst aus dem Handel das Erbgut des Virus nach. Laut einer Studie der tiermedizinischen Hochschule Hannover ist dies nicht überraschend, findet man doch in Deutschland in mindestens 50% aller Schweinebestände HEV-infizierte Tiere.
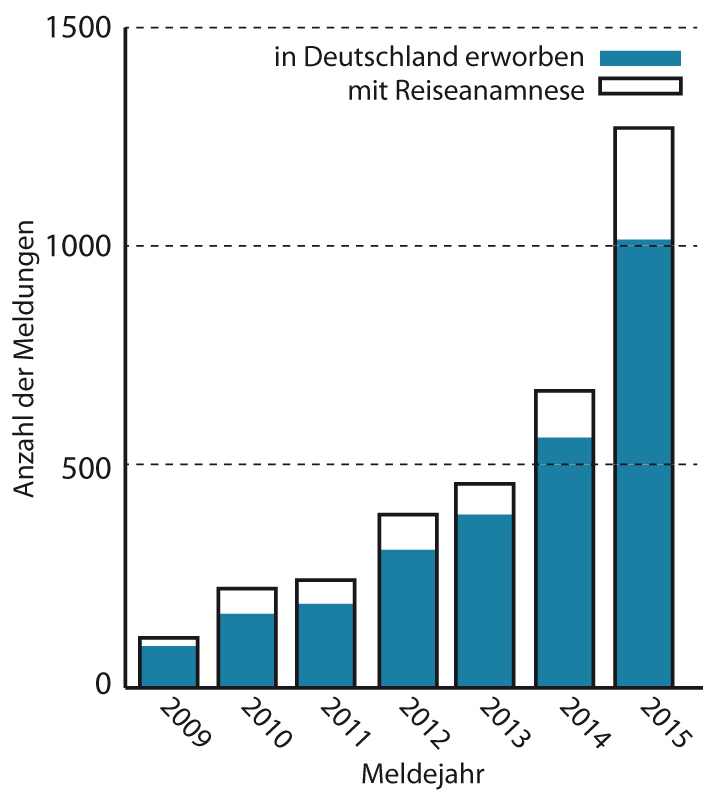
Hepatitis E ist also nicht gleich Hepatitis E. Während die reiseassoziierte Form von Mensch zu Mensch übertragen wird, ist die autochthone Form in Europa weit verbreitet und muss als Zoonose – also eine vom Tier auf den Menschen übertragene Infektionskrankheit – eingeordnet werden. Diese zwei Gesichter der Hepatitis E zeigen sich auch auf molekularer Ebene, denn die reiseassoziierte Form wird durch die Genotypen 1 und 2 verursacht, die autochthone durch die Genotypen 3 und 4. Seit sich dieses Wissen bei medizinischen Laboratorien und behandelnden Ärzten verbreitet, werden immer mehr Hepatitis-E-Fälle gemeldet (siehe Grafik). Obwohl 80% dieser Infektionen in Deutschland erworben wurden, darf bezweifelt werden, dass der Anstieg eine Zunahme der Infektionen in der Bevölkerung widerspiegelt. Ganz im Gegenteil kam die Hepatitis E nach serologischen Bevölkerungsstudien vor einigen Jahrzehnten in Deutschland sogar häufiger vor als heute; die Zunahme der Meldungen ist also wohl vor allem auf höhere Aufmerksamkeit zurückzuführen[3].
Klinik
Schätzungen zufolge leidet nur etwa einer von 600 HEV-Infizierten ein paar Tage lang unter Fieber, Abgeschlagenheit, Oberbauchschmerzen und Gelbsucht. Die meisten merken hierzulande gar nichts von der Hepatitis E. Auch für Schwangere besteht offenbar kein erhöhtes Risiko. Lebensgefährlich ist die Infektion nur für wenige Patienten, zum Beispiel für Lebertransplantierte unter immunsuppressiver Therapie. Mit der geschwächten Immunabwehr sind sie häufig nicht in der Lage, die HEV-Infektion selbst zu überwinden; dann kann es im schlimmsten Fall zum akuten Leberversagen kommen – eine Zwickmühle für die behandelnden Ärzte, da die Immunsuppresion nach Lebertransplantation unverzichtbar ist.
Studien an Patienten nach Transplantation belegen, dass die Hepatitis E bei 1%–5% sogar chronisch werden kann. Der Erreger ist in diesen Fällen für mindestens 6 Monate nachweisbar und kann relativ schnell zu einer Leberzirrhose führen. Darüber hinaus steht HEV seit Kurzem unter Verdacht, in einigen Fällen auch diverse extrahepatische Symptome zu verursachen. Aussagekräftigere Studien sind nötig, um diesen Vermutungen weiter nachzugehen.
Diagnostik
Die Diagnostik der Hepatitis E basiert auf der Detektion spezifischer IgM- und IgG-Antikörper aus Serum oder Plasma, typischerweise als ELISA- oder Immunoblot-Tests, die auch für Genotyp-3-Infektionen eine gute Sensitivität aufweisen. Sie ist nach EBM erstattungsfähig. Leider bietet noch kein großer Hersteller Reagenzien für die vollautomatisierte Testung an.
Fast alle Patienten mit Hepatitis E sind bei Beginn der Symptome bereits HEV-IgM positiv. Kurz danach folgt HEV-IgG. Bei grenzwertigen Ergebnissen sollte sich eine Kontrolluntersuchung nach etwa einer Woche anschließen. Die Aussagekraft eines positiven HEV-IgM-Nachweises nimmt mit der Prävalenz der Hepatitis E im untersuchten Kollektiv ab; deshalb ist ein verdachtsunabhängiges Screening nicht sinnvoll, da man mehr falsch als richtig positive Ergebnisse erhält.
Für Spezialfälle sind verschiedene NAT-Verfahren zum Nachweis der HEV-spezifischen RNA verfügbar. Diese sollten bei Verdacht bei immunsupprimierten Patienten eingesetzt werden, oder wenn eine sehr empfindliche Detektion benötigt wird (z. B. im Blutspenderscreening). Am Konsiliarlabor für HEV können im Spezialfall nach Rücksprache HEV-Genotypisierung und weitere Sonderdiagnostik angefordert werden.
Therapie und Vorbeugung
Die Hepatitis E muss in den meisten Fällen nicht spezifisch behandelt werden. Bei Risikopatienten mit chronischer Hepatitis E genügt oft bereits die Reduktion der immunsuppressiven Therapie, um eine Ausheilung zu erzielen. Des Weiteren hat sich Ribavirin als effektive und sichere antivirale Therapie gegen die Hepatitis E erwiesen (off-label use)[4].
Zur Vorbeugung der autochthonen Hepatitis E wird empfohlen, nur ausreichend hoch und lange erhitzte Schweinefleischprodukte zu verzehren. Eine Studie hat gezeigt, dass für die sichere Inaktivierung mindestens 71 °C für mindestens 20 Minuten nötig sind. Risikopatienten sollte von einem Verzehr solcher Lebensmittel (z. B. Salami) abgeraten werden, da momentan noch unklar ist, ob Pökeln, bakterielle Fermentation oder Räuchern HEV inaktivieren. Auf Reisen ist kontaminiertes Trinkwasser die wichtigste Ansteckungsquelle für HEV. Hier gelten die üblichen Prophylaxeempfehlungen. Der in China entwickelte und offenbar gut wirksame HEV-Impfstoff Hecolin darf zurzeit wegen einer fehlenden WHO-Genehmigung nicht exportiert werden.
In der Transfusionsmedizin wird intensiv diskutiert, ob die Einführung einer generellen Spenderuntersuchung auf HEV-RNA sinnvoll wäre. Verschiedenen Studien zufolge enthält in Deutschland etwa eine von 4.000 Blutspenden HEV-RNA und stellt somit eine potenzielle Infektionsquelle für den Empfänger dar. In den vergangenen Jahren wurden mehrere Übertragungen durch verschiedene Blutprodukte nachgewiesen. Für SD-Plasma schreibt die europäische Pharmakopöe seit 2015 ein generelles Screening vor und in Irland läuft zurzeit eine dreijährige Testphase, in der alle Blutspenden auf HEV-RNA untersucht werden.
Ausblick
Auch in den nächsten Jahren ist in Deutschland mit einer ansteigenden Zahl gemeldeter Hepatitis-E-Fälle zu rechnen. Dies beruht jedoch vorwiegend auf der gesteigerten Aufmerksamkeit, die der Hepatitis E zurzeit zukommt. Ob dieser Entwicklung zusätzlich eine Zunahme der Infektionsfälle zugrunde liegt, wird in epidemiologischen Studien untersucht werden müssen. Nachdem die Hepatitis-E-Durchseuchung in den letzten Jahrzehnten besonders bei 20- bis 40-Jährigen stark abgenommen hat, gibt es zumindest theoretisch wieder einen hohen Anteil an Personen, die für die Infektion empfänglich wären.

Priv.-Doz. Dr. med. Jürgen Wenzel
Universitätsklinikum Regensburg
Konsiliarlabor für HAV und HEV
juergen.wenzel[at]ukr[dot]de

