Transplantat in sicheren Händen
HLA-Antikörper vor und nach Nierentransplantation
Der vor 60 Jahren eingeführte Lymphozytotoxizitätstest (LCT) ist noch heute für die Spender-Empfänger-Auswahl vor Organtransplantationen bedeutsam. Festphasentechniken zum Nachweis von HLA-Antikörpern ermöglichen eine hochsensitive und präzise Bestimmung von HLA-Antikörperspezifitäten im Serum von Patienten. Damit kann das individuelle immunologische Risiko für einen Organempfänger besser beurteilt werden. Nach Transplantation erlauben HLA-Antikörper als Biomarker das Monitoring von Transplantatabstoßungen.
Schlüsselwörter: Nierentransplantation, HLA-Antikörper, xMAP-Technik
Eine Nierentransplantation ist die anerkannt beste Nierenersatztherapie. Lebensdauer des Transplantats und Qualität der Organfunktion hängen wesentlich von der immunologischen Konstellation und Gewebeverträglichkeit, der Histokompatibilität von Spender und Empfänger ab. Humane Leukozytenantigene (HLA), die auf allen kernhaltigen Gewebezellen expremiert sind, spielen als Haupthistokompatibilitäts-Komplex (Major Histocompatibilty Complex, MHC) des Menschen eine zentrale Rolle bei der Auslösung einer zellulären und/oder humoralen Immunantwort nach Organtransplantation (OTX).
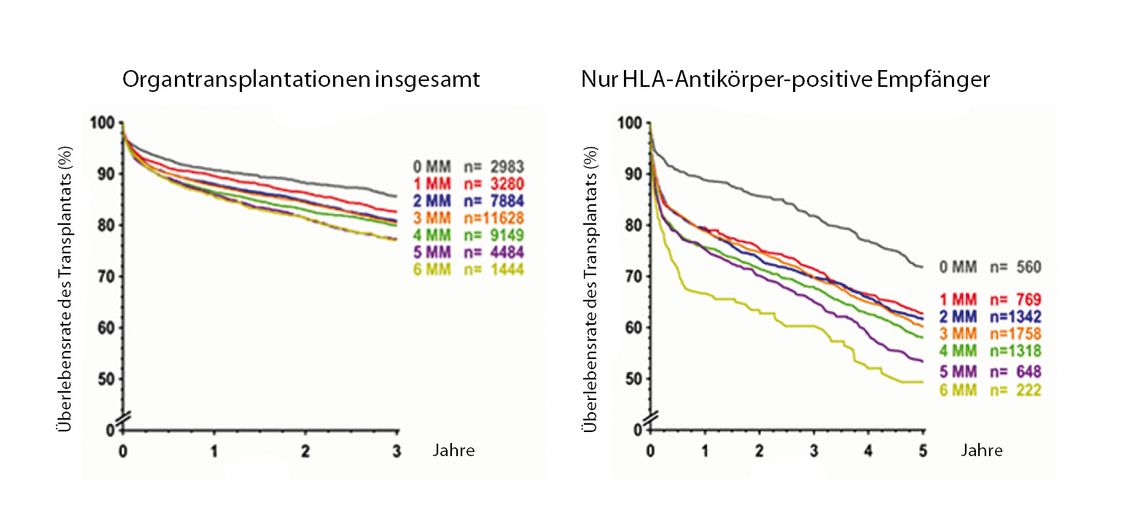
Zur Bestimmung der Histokompatibilität werden die HLA-Loci-A, -B, -C, -DR, -DQ und bei immunisierten Empfängern auch -DP berücksichtigt. Zahlreiche Studien, u. a. die Auswertungen der von Gerhard Opelz 1982 initiierten Collaborative Transplant Study (CTS) beweisen den signifikanten Zusammenhang von Transplantatfunktion und HLA-Übereinstimmung (HLA-Match). Dabei werden mindestens die Loci HLA-A, -B und -DR mit je zwei Antigenen berücksichtigt. Bei der Spender-Empfänger-Auswahl wird in der Regel das HLA-A/B/DR-Mismatch (MM) betrachtet – mit der Summe „0“ für den besten und „6“ für den schlechtesten Matchgrad (siehe Abbildung).
Humorale Abstoßung
Die Halbwertszeit der Lebensdauer von Nierentransplantaten mit 0 MM in den Merkmalen HLA-A, -B, -DR liegt bei 18,2 Jahren, für 6 MM bei 14,2 Jahren. Diese Ergebnisse zeigen einerseits den positiven Einfluss eines guten HLA-Match auf die Transplantatüberlebenszeit (TÜZ), andererseits aber, dass auch Transplantate mit 6 MM lange und gut funktionieren können. Insbesondere Patienten mit HLA-Antikörpern (HLA-Ak) profitieren von einem guten HLA-Match. Eine CTS-Analyse von HLA-Ak-negativen und -positiven Patienten zeigt eine 5-Jahres-Überlebensrate von 75% bzw. 50% bei 0 vs. 6 MM.
Präformierte HLA-Ak sind das Ergebnis einer humoralen Immunantwort nach Schwangerschaften, Transfusionen oder Transplantationen. Sie spielen eine wesentliche Rolle für die Pathophysiologie von humoralen Abstoßungsreaktionen bei OTX; ihr Nachweis im Serum charakterisiert das immunologische Risiko des Transplantatempfängers.
Methodik
Prof. Paul Terasaki etablierte bereits 1964, also vor mehr als 50 Jahren, den Mikro-Lymphozytotoxizitäts-Test (LCT) zum Nachweis von HLA-Ak. 1969 konnte er überzeugend zeigen, dass präformierte HLA-Ak zur Abstoßung von Nierentransplantaten führen[1]. Seitdem ist ein LCT-Crossmatch (XM) mit Lymphozyten des Organspenders und dem Serum des Empfängers Standard. Ein positives LCT-XM mit T-Lymphozyten gilt als Kontraindikation zur Nierentransplantation. Alle LCT-basierten Methoden weisen als Screening- oder Crossmatch-Methode in vitro HLA-Ak nach, die auch in vivo in der Lage sind, Komplement zu binden und damit zu Abstoßungsreaktionen führen. Neuere Methoden sind unabhängig von der Komplementbindungsfähigkeit der Ak. Das gilt zum Beispiel für den ELISA, die Flowzytometrie (FC) und das Bead-basierte Multi-Analyte Profiling (Luminex xMAP-Technologie).
Methodische Unterschiede sind ein wesentlicher Grund für die aktuelle Diskussion über die In-vivo-Relevanz der in vitro detektierten HLA-Ak. Die xMAP-Tests werden sowohl zum Screening (positiv/negativ) als auch zur Ak-Spezifizierung angeboten. Die höchste Sensitivität und präzise Spezifizierung wird mit Single Antigen Bead (SAB) Kits erreicht, bei denen rekombinante HLA-Moleküle einer einzigen HLA-Allel-Spezifität pro Bead gebunden sind. Die korrekte Bewertung dieser SAB-Tests setzt einen hohen Grad an Expertise und Erfahrung voraus. Der aktuelle Stand von Wissenschaft und Technik wurde in einer Consensus Konferenz von Experten aus Europa und den USA zusammengefasst[2].
In Deutschland werden Seren potenzieller Transplantatempfänger in regelmäßigen Intervallen auf das Vorhandensein von HLA-Ak überprüft; bei positivem Befund werden diese dann weiter spezifiziert. Das HLA-Ak-Screening erfolgt aktuell in einer Stufendiagnostik[3], die u. a. in der RiliBÄK zur Transplantationsmedizin und in den Empfehlungen der DGI e. V. beschrieben ist[4].

Dr. Constanze Schönemann
ZTB Zentrum für Transfusionsmedizin
und Zelltherapie Berlin
constanze.schoenemann[at]charite[dot]de