Massenspektrometrischer Resistenznachweis
Labordiagnostik bei nosokomialen Infektionen
Die rasche und sichere Erkennung multiresistenter Erreger stellt hohe Anforderungen an die Labordiagnostik. In der Regel werden kulturelle und molekularbiologische Verfahren im Sinne einer Stufendiagnostik kombiniert, doch deren Aussagekraft ist nicht immer eindeutig. Ein neues massenspektrometrisches Verfahren, das die Inaktivierung von Antibiotika durch den Erreger direkt erfasst, könnte diese analytische Lücke minimieren.
Schlüsselwörter: Multiresistente Erreger, funktionelle Resistenztestung, Massenspektrometrie
Multiresistente Erreger (MRE) gehören zu den größten Herausforderungen, mit denen unser Gesundheitssystem derzeit konfrontiert wird. Vor allem in Krankenhäusern und Pflegeeinrichtungen nimmt die Verbreitung von Methicillin-resistenten Staphylokokken (MRSA), Vancomycin-resistenten Enterokokken (VRE) und multiresistenten gramnegativen Keimen (MRGN) stetig zu.
Bei schweren Infektionen mit septischen Komplikationen steigt die Letalität mit jeder Stunde, in der eine adäquate Therapie verzögert wird. So werden MRE durch die in den Leitlinien empfohlene initial-empirische Antibiotikatherapie häufig nicht ausreichend therapiert. Erschwerend kommt hinzu, dass die mikrobiologischen, kulturbasierten Routinemethoden häufig erst nach zwei bis vier Tagen definitive Ergebnisse liefern.
Deshalb ist neben konsequenter Umsetzung von Hygienemaßnahmen und Vermeidung unnötiger Antibiotikatherapie auch eine qualitativ hochwertige (Eingangs-) Untersuchung der Patienten geboten. Es gilt, multiresistente Keime sowohl schnell als auch sicher zu erkennen. Das stellt hohe Anforderungen an die labordiagnostischen Verfahren.
Schnelle und sichere Diagnostik
Das Screening auf multiresistente Erreger wird derzeit meist in Form einer Stufendiagnostik durchgeführt. Dabei liefert die initiale Kultivierung auf selektiven Chromagarmedien erste Hinweise, die anschließend durch eine schnelle Keimidentifizierung mittels Massenspektrometrie (MALDI-TOF MS) ergänzt werden. Die Prüfung der Resistenz des Erregers und Ermittlung der minimalen Hemmkonzentration (MHK) für die entsprechenden Antibiotika erfolgt dann wiederum mit kulturellen Verfahren.
Allerdings liefert diese als Goldstandard geltende Resistenzerfassung nicht immer aussagekräftige Resultate, da die Expression bei bestimmten Genclustern unterschiedlich ausfallen kann. Das entsprechende Protein wird nämlich auch bei gesichertem molekularbiologischem Nachweis eines bestimmten Resistenzgens nicht unbedingt in ausreichender Menge exprimiert, um eine Antibiotikaresistenz sicher zu erkennen.
So sind zum Beispiel für die β-Lactamasen der MRGN-Keime derzeit über 1.500 Enzymvarianten bekannt. Der durch den Gebrauch von Cephalosporinen und Carbapenemen erzeugte Selektionsdruck in Kombination mit Plasmid-kodierten Resistenzgenen sorgt für eine speziesübergreifende Diversifizierung. Deshalb ist ein umfassender molekularer Schnellnachweis von Resistenzdeterminanten für MRGN-Keime, der u. a. CTX-M, OXA, TEM, SHV und AmpC β-Lactamasen umfasst, extrem aufwendig und derzeit nicht routinemäßig verfügbar.
Innovative Problemlösung
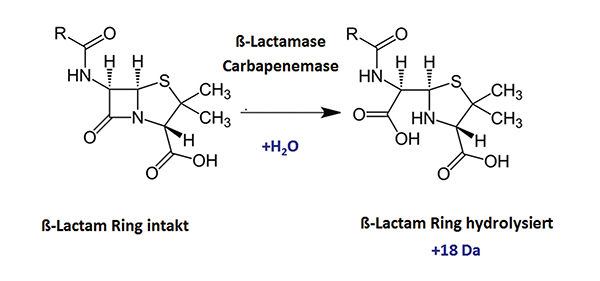
Eine Alternative bieten phänotypische Schnelltests, die die Aktivität der jeweiligen ß-Lactamasen bzw. Carbapenemasen funktionell nachweisen. Diese Enzyme spalten die ß-Lactam-Ringstruktur hydrolytisch und inaktivieren so das Antibiotikum. Bei der Spaltung wird ein Wassermolekül angelagert; das führt zu einem Masseshift von 18 Dalton, der sehr leicht mithilfe der Massenspektrometrie erkannt werden kann (siehe Abbildung).
Da in einer komplexen Probe die alleinige Bestimmung der Molekülmasse oft nicht ausreichend spezifisch ist, können weitere identitätssichernde Maßnahmen durchgeführt werden. Hierzu zählt die Kombination von Flüssigchromatografie (LC) mit Tandem-Massenspektrometrie (MS/MS). Als Massenspektrometer setzt man typischerweise ein Triple-Quadrupole-MS ein: Im ersten Quadrupol wird die Muttermasse selektioniert, im nachgeschalteten zweiten Quadrupol fragmentiert und schließlich in einem dritten Quadrupol analysiert. Die Kombination aus Retentionszeit, Selektion der Muttermasse und Analyse des Fragmentspektrums ermöglicht die eindeutige Detektion und Quantifizierung der Abbauprodukte in einer hochkomplexen Matrix. Das Verfahren findet heute schon routinemäßig beim therapeutischen Drug Monitoring Anwendung und kann in angepasster Form auch gut in die mikrobiologische Praxis integriert werden.
Mit dieser Technologie lassen sich Keime mit geringer bzw. hoher ß-Lactamaseaktivität differenzieren, denn bei MRGN-Keimen erfolgt der Ampicillin-Abbau aufgrund der erhöhten ß-Lactamaseaktivität deutlich schneller als bei Ampicillin-sensitiven Keimen, weshalb die Konzentration an Hydrolyseprodukten im Assay steigt. Durch Bildung einer Ratio wird schon nach 30-minütiger Inkubation einer Bakteriensuspension eine sehr gute Diskriminierung ermöglicht[1].
Für die Probenaufarbeitung und die komplette LC-MS/MS-Analytik müssen etwa 60 Minuten Zeitaufwand kalkuliert werden; nach 90 Minuten liegt das endgültige Resultat vor. Ähnliche Hydrolysetests sind auch für andere Antibiotika wie beispielsweise Imipenem verfügbar.
Vorteilhaft ist die Applikationsmöglichkeit auf dem gleichen MALDI-TOF-Massenspektrometer, das auch für die Bakterienidentifikation verwendet wird[2]. Eine kombinierte Bestimmung mehrerer Antibiotika und entsprechende Multiplex-Analytik ist allerdings nur im LC-MS/MS-Format möglich.
Nach der Definition der KRINKO gelten gramnegative Erreger dann als multiresistent, wenn mindestens drei der folgenden Antibiotikagruppen nicht wirksam sind (Leitsubstanz in Klammern):
1. Acylaminopenicilline (Piperacillin)
2. Cephalosporine der 3. und 4. Generation (Cefotaxim und/oder Ceftazidim)
3. Carbapeneme (Imipenem und/oder Meropenem)
4. Chinolone (Ciprofloxacin)
In einer aktuellen Publikation wurde das gleichzeitige Monitoring von zwei unterschiedlichen Antibiotika (Ampicillin und Cefotaxim) beschrieben, mit dem eine sehr gute Klassifikation zwischen MRGN- und sensitiven Keimen erzielt werden konnte[3]. Die MS-basierte Resistenztestung beschränkt sich allerdings derzeit auf den Nachweis von ß-Lactamase- und Carbapenemase-Aktivität; andere Resistenzmechanismen z. B. gegen Chinolone können nicht erfasst werden.
Ausblick
Nach heutigem Stand ist aufgrund der phänotypischen und genotypischen Variabilität kein einzelnes diagnostisches Verfahren in der Lage, durchwegs verlässliche Ergebnisse zu liefern. Daher wird es auch zukünftig erforderlich sein, verschiedene Verfahren zu kombinieren, um den Spagat zwischen minimaler Analysendauer, Validität der Ergebnisse und Kosteneffizienz zu meistern. Die Forschung auf diesem Gebiet greift den integrativen Aspekt durch Förderung von Verbundprojekten wie PathoSept auf, die molekulare Diagnostik und phänotypische Charakterisierung verbinden. Dazu soll das Wachstumsverhalten von Bakterien unter dem Einfluss von Antibiotika auf einem Chip analysiert werden. Bis solche Systeme routinetauglich sein werden, müssen aber noch einige Jahre Entwicklungsarbeit geleistet werden.

Prof. Dr. Peter Findeisen
MVZ Labor Dr. Limbach & Kollegen Heidelberg
peter.findeisen[at]labor-limbach[dot]de

