Wegweisende Befunde
Klinische Pathologie des kolorektalen Karzinoms
In allen Stadien der Darmkrebsdiagnostik – von der endoskopischen Früherkennung bis zur Zuordnung von Metastasen bei unbekanntem Primärtumor – gibt die Pathologie die Richtung an.
Das kolorektale Karzinom ist ein Paradebeispiel für die Vielfalt der Fragestellungen, auf die der Kliniker vom Pathologen eine Antwort erwartet. Dies beginnt bereits bei der korrekten Benennung: Von einem CRC (colorectal carcinoma) sollte erst dann gesprochen werden, wenn die Neoplasie die Lamina muscularis mucosae penetriert und die Submucosa infiltriert hat. Ist nur die Schleimhaut (Mucosa) betroffen, so empfiehlt die WHO den Begriff „Dysplasie“ oder „hochgradig intraepitheliale Neoplasie“, um eine teure und für den Patienten risikoreiche Übertherapie zu vermeiden.
Erstdiagnose
Zumeist besteht bereits aufgrund des endoskopischen Befundes der hochgradige Verdacht auf das Vorliegen eines CRC. Am häufigsten erkennt man einen zentral schüsselförmig ulzerierten Tumor mit wallartig aufgeworfenen Rändern. Polypös-exophytische oder diffus wandinfiltrierende Karzinome sind seltener. Ferner gibt es neben dem Adenokarzinom vom kolorektalen Typ noch eine Reihe von Sonderformen wie das mikropapilläre und das serratierte Adenokarzinom, das Adenokarzinom mit extrazellulärer Schleimbildung und das Siegelringzell-Karzinom.
Für die Sicherung der Diagnose ist der Nachweis von Karzinomdrüsen zumindest in der Submucosa essenziell, weshalb zu oberflächlich genommene Biopsien unter Umständen keine sichere histologische Karzinomdiagnose zulassen.
Risikoklassifikation
Frühkarzinome (Stadium pT1) findet man in bis zu 12% der bei einer Koloskopie entnommenen Adenomektomiepräparate. Das Risiko eines auf dem Boden eines Adenoms entstandenen Karzinoms steigt mit der Adenomgröße, dem Grad der intraepithelialen Neoplasie und bei Vorhandensein einer villösen Adenomkomponente. Rektum und Sigmoid sind häufiger als die übrigen Kolonabschnitte betroffen.
In dieser Situation lautet die typische Frage an die Pathologie, ob die endoskopische Therapie (Polypektomie, Mukosektomie) ausreicht, oder ob eine operative Therapie mit Entfernung der regionären Lymphknoten erforderlich ist. Bei tiefreichender Submucosainfiltration über 1 mm, niedrigem Differenzierungsgrad (G3, G4) oder dem Nachweis von Lymphgefäßinvasionen muss in bis zu 27% mit lymphogenen Metastasen gerechnet werden; in diesem Fall ist die chirurgische Therapie indiziert.
Bei Tumoren mit geringerer Eindringtiefe, Differenzierungsgrad G1 oder G2 und fehlender Lymphgefäßinvasion sowie kompletter endoskopischer Resektion ist dagegen von einer Niedrigrisiko-Situation mit einem Lymphknotenmetastasierungsrisiko von höchstens 5% auszugehen. Hier kann man die endoskopische Therapie als ausreichend ansehen.
Staging von OP-Präparaten
Die histopathologische Aufarbeitung chirurgisch resezierter Dickdarmkarzinome erfolgt in der pTNM-Klassifikation nach UICC (Union internationale contre le cancer 2010). Die beiden wichtigsten histopathologischen Parameter sind Tiefe der Tumorinfiltration in der Darmwand (pT-Kategorie) und An- oder Abwesenheit von Lymphknotenmetastasen (pN-Kategorie). Zur Beurteilung gehört auch die Suche nach Tumorzellen in Blut- und Lymphgefäßen, der Grad der Tumordifferenzierung (Grading) sowie die Frage einer möglichen Tumorinfiltration von chirurgischen Resektionsrändern.
Mesorektum-Beurteilung
Bei radikaler Entfernung von Rektumkarzinomen durch anteriore Resektion oder Rektum-Extirpation hat eine adäquate Mesorektum-Exzision wesentliche prognostische Bedeutung. Im histologischen Befund ist daher festzustellen, ob die Kriterien einer adäquaten Mesorektum-Exzision erfüllt sind. Bei Karzinomen des mittleren und unteren Rektumdrittels wird eine sogenannte totale Mesorektum-Exzision (TME), das heißt die Entfernung des Mesorektums bis zum Beckenboden, gefordert. Bei Karzinomen des oberen Drittels genügt eine partielle Mesorektum-Exzison (PME), das heißt die Entfernung des Mesorektums deutlich unterhalb des aboralen makroskopischen Tumorrandes (5 cm bei Messung in situ bzw. 3 cm bei Messung am frischen, nicht aufgespannten Resektat).
Die Oberflächenbeschaffenheit des Resektates bei TME und PME ist bei hoher Qualität des chirurgischen Eingriffes glatt und lipomartig, ohne Defekte und ohne Einrisse der Grenzlamelle. Suboptimal sind umschriebene Defekte der Grenzlamelle, inadäquat solche mit sichtbarer Rektummuskulatur oder Einrisse bis ins Darmlumen.
Therapiebewertung
Die neoadjuvante Radiochemotherapie stellt die Standardtherapie bei lokal fortgeschrittenen Rektumkarzinomen (Stadium II und III) dar. Sie soll zum einen das Auftreten von Lokalrezidiven verringern, zum anderen durch präoperative Tumorverkleinerung die Chancen für eine Sphinkter-erhaltende Operation erhöhen.
Der histopathologische Befund muss grundsätzlich auch die Regression des Tumors quantifizieren. In Deutschland erfolgt die Graduierung meist nach dem Verhältnis von Tumorzellmasse, Fibrose und Strahlenvaskulopathie; dabei bedeutet Grad 0 keine Regression, Grad 4 eine totale Regression mit Fibrose ohne Nachweis von Tumorzellen.
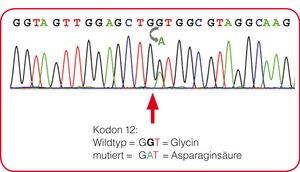
Mutationsstatus
Eine intakte EGFR-abhängige Signalkaskade in den Tumorzellen ist Voraussetzung für die erfolgreiche medikamentöse Anti-EGFR-Therapie des CRC mit Panitumumab oder Cetuximab. Etwa jeder zweite Patient weist Mutationen im KRAS- oder NRAS-Gen auf und profitiert deshalb von dieser Therapie nicht. Die Präparate sind folglich nur dann für die CRC-Therapie zugelassen, wenn beide (!) Gene in Wildtypkonformation vorliegen.
Da KRAS-Mutationen wesentlich häufiger als NRAS-Mutationen vorkommen, ist aus wirtschaftlichen Erwägungen zunächst eine Mutationsanalyse des KRAS-Gens indiziert. Bei positivem Befund sind keine weitere Untersuchungen im NRAS-Gen notwendig; andernfalls schließt sich eine NRAS-Mutationsanalyse an.
Hinweis auf hereditäre Ursachen
Pathologen können eine wichtige Weichenstellung zum Nachweis einer möglichen hereditären Kolonkarzinom-Entstehung geben. Vor allem Adenokarzinome mit extrazellulärer Schleimbildung und Siegelringzell-Karzinome sollten den Verdacht auf das Vorliegen eines Karzinoms im Rahmen eines erblichen Lynch-Syndroms aufkommen lassen. Eine erste orientierende Untersuchung zur weiteren Abklärung dieses Verdachts besteht in der immunhistologischen Untersuchung für die Mismatch-Repair-Proteine MLH 1, PMS 2, MSH 2 und MSH 6.
Unbekannter Primärtumor
Bei der histopathologischen Untersuchung von Metastasen stellt sich gelegentlich die Frage nach dem Primärtumor (cancer of unknown primary, CUP). Es gibt keinen singulären immunhistologischen Marker, der ein primäres kolorektales Karzinom ausschließt oder beweist. Daher werden Kombinationen verschiedener Antikörper eingesetzt, die beim CRC entweder besonders häufig (zum Beispiel Zytokeratin 20: positiv in etwa 89%) oder besonders selten (zum Beispiel Zytokeratin 7: positiv in 13%) exprimiert werden. Auch der Nachweis von CDx2 spricht für ein CRC als Primärtumor.
Zum Ausschluss anderer Adenokarzinome kommen in der histochemischen Färbung Antikörper gegen TTF1 (Lunge), Pax 8 (weiblicher Genitaltrakt) und Gata 3 (Mamma) zum Einsatz.

Prof. Dr. med. Mario Sarbia
Pathologie München-Nord
sarbia[at]pathologie-muenchen[dot]de