Evaluation eines automatisierten PCR-Workflows
artus CT/NG QS-RGQ Kit
Am Medizinischen Infektiologiezentrum Berlin (MIB) wurde der qualitative artus CT/NG-Testkit von Qiagen im automatisierten Workflow zum qualitativen Nachweis von Chlamydia trachomatis und Neisseria gonorrhoeae (CT/NG) auf der QIAsymphony- und Rotor-Gene Q-Plattform auf seine klinische Effizienz getestet.
Hintergrund
Infektionen mit Chlamydia trachomatis und mit Neisseria gonorrhoeae gehören zu den häufigsten sexuell übertragbaren Erkrankungen (STI). CT-Infektionen verlaufen bei Männern und Frauen zu Beginn oft relativ symptomlos, können aber im Verlauf zu Unfruchtbarkeit führen und weitere STIs, z. B. HIV, begünstigen (Epidem. Bulletin RKI 46/2013 und 37/2014).
Bei Chlamydia trachomatis unterscheidet man anhand der Oberflächenstrukturen verschiedene Serovare A–C, D–K und L1–L3, die auch jeweils für unterschiedliche Krankheitsbilder verantwortlich sind. Während die Serovare A–C überwiegend in den Entwicklungsländern auftreten und ein Trachom verursachen können, das zur Erblindung führt, sind es in den Industrieländern die Serovare D–K, die zu dem oben beschriebenen überwiegend asymptomatischen Verlauf führen können. Die Serovare L1–L3 sind als Auslöser von Lymphogranuloma venereum und Elephantiasis bekannt. Zumindest für die Serovare D–K gilt, dass sich die Infektion mit Doxycyclin als Standardtherapie relativ problemlos behandeln lässt, wodurch das Screening einen besonderen Stellenwert bekommt (RKI Epidem. Bulletin, 37/2014).
Neisseria gonorrhoeae gehört zu den gramnegativen Diplokokken, die eine bei 30–80% der Frauen und 5% der Männer nahezu asymptomatisch verlaufende Infektion hervorrufen. Besonders rektale Infektionen bei Männern verlaufen oft symptomlos. Die Gonokokken entwickeln zunehmend Resistenzen, sodass neben dem Screening mit NAT-Verfahren möglichst eine Kultur zur Ermittlung des Antibiogramms angelegt werden sollte.
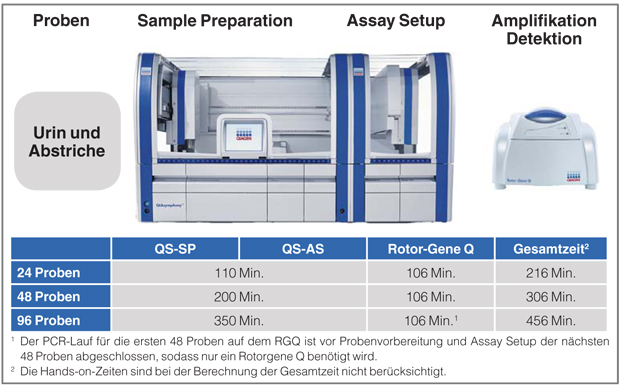

Studienkonzept
Das privatwirtschaftlich organisierte MIB ist auf Infektiologie mit einem Schwerpunkt im Bereich HIV und Hepatitis spezialisiert. Neben der üblichen Labordiagnostik bietet es die Bestimmung des Immunstatus (Differenzierung der Lymphozytensubpopulationen), den direkten Erregernachweis mittels NAT (qualitativ und Viruslast) und genotypische Analysen viraler Resistenzen (HIV, HBV, HCV) an.
Für die Studie wurden am MIB 400 Proben retrospektiv untersucht, davon 50% Abstrich- und 50% Urinproben, die alle in Abbott Multi Collect Tubes gesammelt wurden. Als Referenztest diente der Abbott m2000sp/rt-Assay. Bedingt durch den Laborschwerpunkt HIV und Hepatitis besteht die Mehrzahl der Einsender bis heute aus Praxen mit dem Patientenkollektiv MSM (Männer, die Sex mit Männern haben) oder iv-Drogengebrauchern. In dieser Kohorte sind höhere Raten an STI („sexuell transmitted infections“) beschrieben. Zurzeit befinden sich unter den Einsendern lediglich zwei gynäkologische Praxen, die aufgrund der entsprechenden Richtlinien zur Mutterschaftsvorsorge nahezu ausschließlich Urinproben zum Screening auf Chlamydia trachomatis einsenden. Daher stammen die untersuchten Abstrichproben ausschließlich von männlichen Patienten (s. auch Tab. 1).
Testkits
Die beiden hier gegenübergestellten Testkits weisen mit Hilfe der PCR im Falle von CT zwei, im Falle von NG eine für den Erreger typische DNA-Sequenz(en) nach.
Testkit artus CT/NG QS-RGQ
CT-PCR: ein Einzelkopie-Ziel „momp = major outer membrane proteine“ und eine Sequenz in einem „cryptic plasmid” (CP), 5–10 Kopien pro Zelle
NG-PCR: eine Zielregion in einem Multikopie-ORF (open reading frame) des NG-Genoms (5–10 Kopien/Zelle), Funktion unbekannt
Testkit Abbott RealTime CT/NG
CT-PCR: unterschiedliche Anteile des „cryptic plasmid” (CP), 5–10 Kopien pro Zelle
NG-PCR: eine Zielregion im „OPA-Gen“ („opacity“, bis zu 11 Kopien pro Zelle)
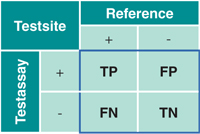
Auswertung
In der retrospektiven Studie wurden die Ergebnisse des artus CT/NG QS RGQ-Workflow einer Referenzmethode gegenübergestellt (Abb. 1). Die Bewertung erfolgte rein qualitativ als falsch negativ (FN), falsch positiv (FP), richtig positiv (TP) und richtig negativ (TN) wie in der Vierfeldertafel dargestellt.
Aus den Ergebnissen errechnen sich die Kenngrößen der diagnostischen Trennschärfe wie folgt:
Spezifität (%) = (TN / (TN + FP)) x 100
Sensitivität (%) = (TP / (TP + FN)) x 100
Konkordanz (%) = (TP + TN) / Gesamtzahl) x 100
Ergebnisse
Der Vergleich mit dem Abbott-Test als Referenz ergab sehr gute Übereinstimmungen mit hoher Spezifität für beide Erreger (99,7% für CT und 97,6% für NG, s. Abb. 2) ohne signifikante Unterschiede zwischen den Probentypen Urin und Abstrich. Die Sensitivität war leicht niedriger (94,5% bzw. 93%), was allerdings den teilweise relativ niedrigen Positivraten geschuldet ist und sich durch zwei bzw. drei mit dem artus-Test nicht positiv getestete Proben bei insgesamt 44 bzw. 43 positiven Proben errechnet.
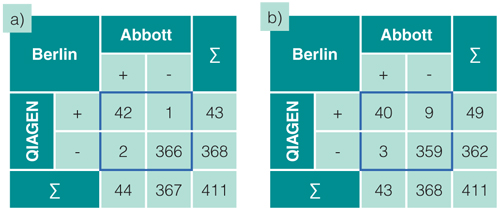
Abb. 2: Diagnostische Sensitivität und Spezifität für den Nachweis von a) Chlamydia trachomatis und b) Neisseria gonorrhoeae:
CT: Klinische Spezifität (%) = (366 / (366 + 1)) x 100 = 99,7%
Klinische Sensitivität (%) = (42 / (42 + 2)) x 100 = 94,5%
NG: Klinische Spezifität (%) = (359 / (359 + 9)) x 100 = 97,6%
Klinische Sensitivität (%) = (40 / (40 + 3)) x 100 = 93,0%
Allerdings beobachteten wir dreimal mehr diskordant (artus positiv, Abbott negativ) positive NG Proben (9; 7 Abstriche + 2 Urine) mit dem artus-Kit als mit dem Abbott-Kit (artus negativ, Abbott positiv; insgesamt 3, davon 2 Abstriche). Dies könnte ein Hinweis für eine etwas höhere Sensitivität im NG artus-Test sprechen. Die diskordanten Proben wurden mit relativ hohen CT-Werten im artus-Test gemessen. In anschließenden Kontrollen der Originalkurvenverläufe dieser Proben im Abbott-Test konnte bei vier der neun Proben ein diskret positives Signal, deutlich nach dem testspezifischen Cut-Off gesehen werden.
Für die Detektion von CT sahen wir eine diskordante Abstrichprobe mit dem artus-Test und zwei Diskordante mit Abbott-Kit, was keinen Hinweis auf einen Sensitivitätsunterschied für die Detektion von Chlamydia ergibt.
Zu beachten bleibt hierbei, dass das Studiendesign nicht darauf ausgerichtet war, Unterschiede im niedrig positiven Bereich zu evaluieren.
Zusammenfassung
• Sehr gute Konkordanz zwischen den beiden getesteten Systemen mit 99,3% für Chlamydia und 97,1% für Neisseria.
• Sehr hohe Sensitivität für den artus CT/NG-Test mit einem vorsichtigen Hinweis auf eine leichte Überlegenheit für die NG-Detektion im Vergleich zum Abbott RealTime-Test.
• Die Durchführung der Verifikations- und Validations-Studie bestätigt die Praxistauglichkeit und Konkurrenzfähigkeit des neuen artus CT/NG QS-RGQ für die Detektion von C. trachomatis und N. gonorrhoeae in der modernen Routinediagnostik.
• Die präsentierte Anwendung ist eingeführt als CE-markierter Arbeitsablauf für die In-vitro-Diagnostik.


Autorenkontakt:
Dr. rer. nat. Robert Ehret,
Dr. med. Martin Obermeier
Labor Berg im MIB Medizinisches Infektiologiezentrum Berlin

