Zwei Seiten einer Medaille
Immundefizienz und Autoimmunität
Immundefizienz und Autoimmunität scheinen auf den ersten Blick die entgegengesetzten Pole der Aktivität des Immunsystems zu sein. Der klinische Alltag zeigt hingegen, dass sie bei einigen Erkrankungen gemeinsam auftreten können. Ein verbessertes Verständnis der zugrunde liegenden genetischen Veränderungen und Molekularbiologie erlaubt Einsichten in die Pathophysiologie dieser Erkrankungen und ihre zielgerichtete Behandlung. Dieser Übersichtsartikel fasst die wichtigsten Assoziationen von primären Immundefekten und Autoimmunität im Rahmen primärer Immundefekte zusammen, erörtert ihre molekulare Krankheitsentstehung und Therapiemöglichkeiten und gibt einen Ausblick auf mögliche künftige Entwicklungen.
Schlüsselwörter: Immundefekt, B-Zellen, T-Zellen
Einleitung
Stellt man sich die Aktivität des menschlichen Immunsystems als Kontinuum vor, so erscheint es einfach: Ein überaktives Immunsystem sorgt zwar für einen guten Schutz vor Krankheitserregern und anderen äußeren Gefahren, attackiert jedoch den eigenen Körper. Diese Gefahr wird durch ein inaktiveres Immunsystem vermieden, jedoch zum Preis von vermehrten Infektionen. Hier erschiene wenig einleuchtend, wie Immundefizienz mit Autoimmunität einhergehen kann. Die Realität in der Klinik zeigt jedoch, dass dieses Modell zu einfach ist, denn Autoimmunität kann die Folge eines dysfunktionalen Immunsystems sein. Immundefizienz und Autoimmunität können somit, scheinbar paradoxerweise, zwei Seiten einer Medaille darstellen.
Die komplexen Wechselwirkungen zwischen Immundefizienz und Autoimmunität lassen sich einteilen in primäre, sekundäre und tertiäre Assoziationen. Diese Arbeit betrachtet in erster Linie das gemeinsame Auftreten von Immundefizienz und Autoimmunität im Rahmen von genetischen Erkrankungen, also die primären Assoziationen. Sekundär kann eine Manifestation eine andere verursachen, so wie beispielsweise eine autoimmune Zerstörung von neutrophilen Granulozyten zu Immundefizienz führt. Schließlich kann in tertiären Fällen die Immundefizienz eine Nebenwirkung der Behandlung der Autoimmunität sein.
Genetische Risikofaktoren
Primäre Immundefekte und rheumatische Erkrankungen zählen zu den genetisch am intensivsten erforschten immunologischen Erkrankungen. So konnten durch eine Metaanalyse Genom-weiter Assoziationsstudien mit fast 30.000 an rheumatoider Arthritis erkrankten Patienten und nachfolgende bioinformatische Analyse 98 Gene (außerhalb der bekannterweise für die Krankheitsentstehung wichtigen Haupthistokompatibilitätskomplexe (MHC)) identifiziert werden, welche mit der Erkrankung assoziiert waren [1]. Durch Varianten in den Genen wurde das Erkrankungsrisiko bei dieser polygen vererbten Krankheitsform mindestens verdoppelt. In 15 dieser 98 Gene sind kausale Varianten für monogen vererbte primäre Immundefektsyndrome bekannt [2,3]. Auch für den systemischen Lupus erythematodes sind über 50 Risikoloci bekannt, welche außerhalb der MHC-Regionen liegen. Hierzu zählen Varianten, welche den Interferon-alpha-Stoffwechselweg beeinflussen, und Gene aus dem Komplementsystem. Beide Stoffwechselwege sind als monogene Ursachen für angeborene Lupuserkrankungen bekannt [4,5].
Primäre Immundefekte, die sich auch durch Autoimmunität manifestieren können, beinhalten meist Störungen der B-/T-Zell-Entwicklung und -Funktion, Komplementdefekte oder eine überschießende Inflammation durch Apoptosedefekte. Darüber hinaus existieren seltenere monogene Formen primärer Immundefizienz, welche zum Teil nur aus einzelnen Fallberichten bekannt sind und hier nicht vollständig diskutiert werden können.
Störungen der T-Zell-Entwicklung
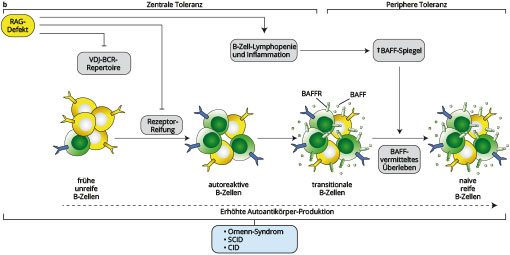
Die Rekombinasen RAG1 und RAG2 werden in der Entwicklung von Lymphozyten exprimiert. Im Rahmen der somatischen Rekombination vermitteln sie Doppelstrangbrüche in der DNA, wodurch aus dem Arsenal der variablen Genabschnitte V, D und J die Sequenz für die Antigen-bindenden Bereiche des Immunglobulin- sowie T-Zellrezeptors zusammengesetzt wird. Fehlt eines der Enzyme, führt dies zu einem schweren kombinierten Immundefekt (severe combined immunodeficiency, SCID) mit vollständig abwesenden B- und T-Zellen bei erhaltenen NK-Zellen. Klinisch fällt dies durch lebensbedrohliche Infektionen auf. Hypomorphe Varianten mit erhaltener Restaktivität der Enzyme bieten ein breites Spektrum klinischer Manifestationen. Ein Beispiel hierfür ist das Omenn Syndrom, welches durch Erythrodermie, Lymphadenopathie und Hepatosplenomegalie, sowie eine Infektneigung bei Hypogammaglobulinämie mit erhöhten IgE Spiegeln auffällt. Die wenigen generierten T-Lymphozyten sind kaum einer Kompetition um Überlebensfaktoren ausgesetzt, wodurch auch weniger affine autoreaktive T-Lymphozyten proliferieren können. Darüber hinaus sind auch regulatorische T-Zellen in Zahl und Funktion vermindert. Die gemeinsame Endstrecke sind Organinfiltrationen oligoklonaler, aktivierter T-Zellen ähnlich einer Graft-versus-Host-Reaktion.
Eine Störung der B-Zell-Reifung resultiert beim Omenn-Syndrom in einer B-Lymphopenie. Durch vermehrte Verfügbarkeit des B-cell activating factors (BAFF) kommt es zu einer gestörten negativen Selektion und Expansion von autoreaktiven B-Zellen [8]. Die Folge sind zirkulierende Autoantikörper, welche mit weiteren autoimmunen Manifestationen wie Alopezie, Myasthenia gravis, Vitiligo und Psoriasis einhergehen.
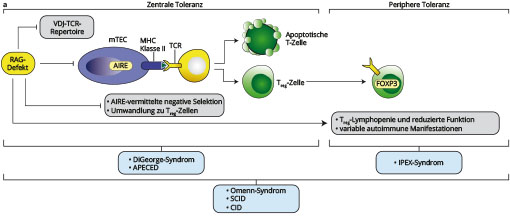
Auch Störungen der T-Zell-Reifung und der zentralen Toleranzentwicklung führen als gemeinsame Endstrecke zu Autoimmunität. Beispiele hierfür sind Mutationen im Gen für den Transkriptionsfaktor Autoimmun-Regulator (AIRE), welches die Autoantigenpräsentation im Thymus reguliert; im DNA-Reparaturenzym DCLRE1C/Artemis, welches im Rahmen der V(D)J-Rekombination die Reparatur des Doppelstrangbruches vermittelt; sowie das Mikrodeletionssyndrom 22q11, auch DiGeorge-Syndrom genannt, das zu einem hypoplastischen oder vollständig fehlenden Thymus mit konsekutiver Störung der T-Zellentwicklung führt.
Unzureichende T-Zell-Regulation
Neben der negativen Selektion autoreaktiver T-Zellen im Rahmen ihrer Entwicklung im Thymus ist auch die dämpfende Funktion regulatorischer T-Zellen (Tregs) notwendig, um eine überschießende Reaktion des Immunsystems gegen körpereigene Strukturen zu verhindern. Dies wird deutlich durch monogene Defekte, welche zu fehlenden oder nicht korrekt funktionierenden Tregs führen. Mutationen im auf dem X-Chromosom lokalisierten Gen für den Transkriptionsfaktor FOXP3 verursachen ein vorwiegend Männer betreffendes Polyautoimmunsyndrom, zu dessen häufigsten Manifestationen chronisch-entzündliche Darmerkrankung, Typ-1-Diabetes und Dermatitis gehören (immune dysregulation, polyendocrinopathy, enteropathy, X-linked (IPEX) syndrome). Durch die in Anzahl und Funktion eingeschränkten regulatorischen T-Zellen kommt es zu einer Enthemmung der Immunantwort mit einer vermehrten Aktivierung und Proliferation insbesondere von TH2-Zellen und B-Zellen mit konsekutiver Produktion von Autoantikörpern.
Ein verschobenes Gleichgewicht von positiv- und negativ-kostimulatorischen Signalen führt bei den monogenen Erkrankungen CTLA4- und LRBA-Defizienz zu einer überschießenden T-Zell-vermittelten Immunreaktion. CTLA4 wird auf der Oberfläche von regulatorischen T-Zellen exprimiert. Es bindet an CD80/86, welches auf der Oberfläche von Antigen-präsentierenden Zellen vorhanden ist und als Ligand des auf T-Zellen exprimierten Oberflächenmoleküls CD28 neben dem MHC:TCR-Signal als zweiter Signalgeber zur Aktivierung der Zelle nötig ist. Die Bindung von CTLA4 an CD80/86 erfolgt mit höherer Affinität; in der Folge wird Letzteres im Rahmen der Transendozytose von der Oberfläche der Antigen-präsentierenden Zelle entfernt, in die regulatorische T-Zelle aufgenommen und dort abgebaut. Durch die reduzierte Kostimulation über CD80/CD86 wird die T-Zell-Aktivierung abgeschwächt. Die Rezirkulation von CTLA4 vom Lysosom zur Zelloberfläche wird durch das zytoplasmatische Protein LRBA vermittelt. Fehlt LRBA, wird CTLA4 abgebaut und seine hemmende Wirkung unterbleibt. Die Manifestationen der CTLA4- und LRBA-Defizienz sind vielfältig und umfassen Autoimmun-Zytopenien, chronisch-entzündliche Darmerkrankungen und Lymphoproliferation. Darüber hinaus kommt es zu einer Infektneigung, deren molekulare Pathogenese am ehesten durch eine begleitende Hypogammaglobulinämie zu erklären ist. Diese beruht vermutlich auf einer progredienten Entzündung im Knochenmark, welche durch Effektor-T-Zellen vermittelt wird. Während die autosomal-rezessiv vererbte LRBA-Defizienz meist in den ersten Lebensjahren manifest wird, erkranken Anlagenträger des autosomal-dominanten Immundefekts CTLA4-Defizienz teils erst im Erwachsenenalter oder bleiben ein Leben lang asymptomatisch. Mit den für rheumatoide Arthritis beziehungsweise nach Nierentransplantation zugelassenen CTLA4-Fc-Fusionsproteinen Abatacept/Belatacept stehen vielversprechende Optionen für eine zielgerichtete Therapie zur Verfügung, welche in klinischen Studien für diese primären Immundefekte erprobt werden sollten [6, 7].
Konstitutive T-Zell-Aktivierung
Die Delta-Isoform der Phosphoinositid-3-Kinase ist an der intrazellulären Signaltransduktion in Leukozyten beteiligt. Auf Bindung von Liganden an B-Zell- und T-Zellrezeptor sowie kostimulatorische Rezeptoren katalysiert sie die Phosphorylierung von Phosphatidylinositol-4,5-bisphosphat, wodurch die weitere Signalkaskade der Zellaktivierung vermittelt wird. Durch aktivierende Mutationen in den Genen PIK3CD und PIK3R1, welche die katalytische beziehungsweise regulatorische Untereinheit des Enzyms kodieren, kommt es zu einer konstitutiven Aktivierung. Dies führt zu einer Lymphoproliferation und überschießenden Effektorfunktionen, welche in einer autoimmunen Zerstörung von Blutzellen, Entzündung des Magen-Darm-Traktes und autoimmunen Lungenerkrankungen resultieren. Auch hier ist eine maßgeschneiderte Therapie durch einen PI3Kδ-Inhibitor derzeit in Erprobung.
Nach Bindung der Liganden an verschiedene Zytokinrezeptoren wird die intrazelluläre Rezeptordomäne durch Januskinasen (JAK) phosphoryliert, gefolgt von einer Phosphorylierung der Transkriptionsfaktoren STAT 1/3. Hierauf dimerisieren diese und werden in den Zellkern verlagert. Durch Modifizierung der Transkription werden Proliferation, Apoptose und Zelldifferenzierung beeinflusst. Während loss-of-function Mutationen in den Genen der Transkriptionsfaktoren STAT1 und STAT3 zu rezidiverenden Infektionen ohne Autoimmunität führen, können aktivierende Mutationen autoimmune Manifestationen und Immundefizienz zur Folge haben. Die dysregulierte STAT1- und STAT3-Signaltransduktion führt u. a. zu einer überaktivierten Interferon-Typ-I-Produktion. Interessanterweise beobachtet man auch bei monogenen Formen von systemischem Lupus erythematodes ein ähnliches Aktivierungsprofil, welches auf Mutationen in Genen für verschiedene
Nukleasen (TREX1, DNAse1, DNAse1L3, RNAseH2) und den hierdurch gestörten Abbau überschüssiger zytosolischer DNA zurückzuführen ist.
Komplementdefekte
Das Komplementsystem spielt durch Opsonierung eine wichtige Rolle in der Beseitigung von apoptotischem und nekrotischem Material. Ist dieser Abräumprozess gestört, so werden die intrazellulären Antigene nicht wie üblich in Milz und Leber abgebaut, sondern können von Antigen-präsentierenden Zellen phagozytiert werden und eine spezifische Immunantwort generieren. Dies zeigt sich bei monogenen Komplementdefekten, welche, neben gehäuften Infektionen mit bekapselten Bakterien, eine Assoziation mit systemischem Lupus erythematodes zeigen. Betroffen sind insbesondere die frühen Komplementbestandteile C1q, C1r/s, C2 und C4.

Regulation der Inflammation
Um Kollateralschäden zu verhindern, wird die physiologische Immunantwort streng reguliert. Nach Proliferation von T- und B-Zellen im Rahmen der Immunantwort geht der Großteil dieser Zellen in Apoptose. Vermittelt wird dies unter anderem durch eine Bindung des Fas-Liganden an den zugehörigen Rezeptor, wodurch über mehrere Caspasen die Apoptose in Gang gesetzt wird. Ist dieser Weg gestört, wie es bei Mutationen in den Genen für Fas-Rezeptor, Fas-Ligand und Caspase-10 der Fall sein kann, so kommt es zum autoimmunen lymphoproliferativen Syndrom (ALPS). Bei dieser meist im Kindesalter manifest werdenden Erkrankung führt die gestörte Apoptose zu einer Expansion von Lymphozyten mit Splenomegalie und Lymphadenopathie. Zytopenien durch einen verstärkten Abbau in der Milz oder eine autoimmune Zerstörung und Organinfiltrationen von Lymphozyten sind häufig; auch Lymphome treten bei diesen Patienten vermehrt auf.
Fazit
Obwohl die große Mehrheit der Autoimmunerkrankungen keine monogene Ursache hat, so ist doch das Erkennen dieser seltenen monogenen Formen von entscheidender Bedeutung, da in einigen Fällen eine effektive, zielgerichtete Therapie möglich ist. Beispiele hierfür sind die CTLA4-/LRBA-Defizienz und die hier nicht besprochene ADA2-Defizienz. Ähnlich wie in der Onkologie können so anhand der molekularen Krankheitsursache wirksame Medikamente ausgewählt werden, und den Patienten möglicherweise nebenwirkungsreiche Behandlungen mit wenig Nutzen erspart werden. Es ist zu erwarten, dass mit den verbesserten Möglichkeiten der Phänotypisierung und Genotypisierung, insbesondere durch neue Sequenziermethoden, in Zukunft weitere monogene Autoimmunsyndrome identifiziert werden können. Umgekehrt erlaubt das verbesserte Verständnis der zugrunde liegenden Stoffwechselwege die Entwicklung neuer Medikamente, sodass eine weitere Individualisierung der Behandlung zu erwarten ist.


