Biomarker für eine personalisierte Therapie
Diagnostik der Leukämien und Lymphome
Für die Diagnostik von Leukämien und Lymphomen steht ein breites Spektrum an ganz unterschiedlichen Methoden zur Verfügung, aus deren Kombination sich das Verständnis der Erkrankung und letztendlich die maßgeschneiderte Therapie entwickeln. Das Mikroskop bleibt die Basis, aber molekulardiagnostische Biomarker für die personalisierte Medizin werden die Zukunft der Hämato-Onkologie bestimmen.
Gerade im Bereich der Leukämien und Lymphome hat sich das Methodenspektrum für Screening und Diagnostik in den letzten Jahren ständig erweitert. Auf der phänotypischen Ebene kam zur lange erprobten Zytomorphologie und (Immun-) Histologie die Immunphänotypisierung mit fünf bis zehn Farben hinzu, und in der Genomik spielen neben den sehr aufwendigen Methoden der klassischen Chromosomenanalyse zunehmend molekulardiagnostische Methoden wie Nukleinsäureamplifikation (NAT), Fluoreszenz-in-situ-Hybridisierung (FISH) und Gensequenzierung (NGS) eine bedeutsame Rolle.
Aus diesen unterschiedlichen Bereichen stellen Diagnostika-Firmen im vorliegenden Heft ihre größtenteils CE-IVD-zertifizierten Assays vor – vom vollautomatischen PCR-Test im Kartuschenformat bis zum NGS-Testkit für die umfassende Typisierung und Quantifizierung maligner B- und T-Zellen (siehe nebenstehende Produktbeschreibungen). Den Gerätesystemen für die Durchflusszytometrie haben wir eine eigene Übersicht mit einem ausführlichen tabellarischen Vergleich auf den Seiten 182 bis 187 gewidmet.
Erwähnenswert ist in diesem Zusammenhang auch die Vielfalt der laboreigenen Entwicklungen (In-house-Assays) und RUO-Verfahren (research use only) in der Hämato-Onkologie. Solche Methoden tragen nicht nur dem wissenschaftlichen Fortschritt Rechnung, sondern auch den „Schattenseiten“ der personalisierten Medizin: Sie ist ja definitionsgemäß auf wenige Patienten zugeschnitten, was zu kleinen, eher unwirtschaftlichen Fallzahlen führt. Die Ergebnissicherheit der Eigenentwicklungen wird in aller Regel durch die Akkreditierung des Labors nach ISO EN 15189 gewährleistet.
Companion Diagnostics
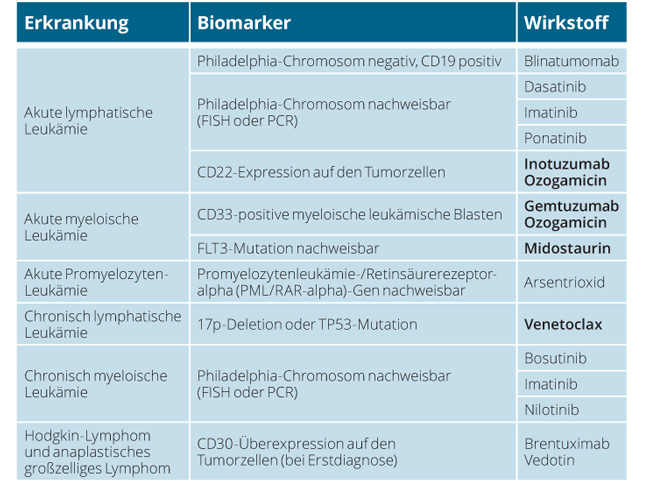
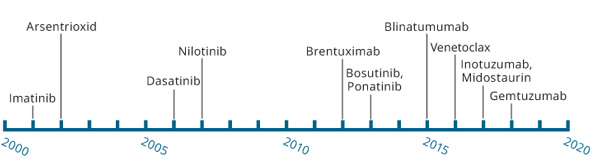
Tab. 1 gibt einen Überblick über Biomarker (Companion Diagnostics, CDx), die im Rahmen einer modernen, zielgerichteten Therapie verpflichtend nachgewiesen werden müssen, ehe einer der insgesamt zwölf aufgelisteten Wirkstoffe verordnet werden darf. In letzter Zeit hat die Zahl dieser personalisierten Medikamente stark zugenommen: Während in den zeJahren ab 2001 nur vier derartige Substanzen (Imatinib, Arsentrioxid, Dasatinib und Nilotinib) zugelassen wurden, verteilten sich die jüngsten vier Zulassungen auf nur 16 Monate. Und dieser rasche Anstieg wird sicher noch lange anhalten, denn die gezielte, Biomarker-basierte Behandlung stellt die Zukunft der Krebstherapie dar.
Ende 2016 wurde Venetoclax als Therapeutikum für Patienten mit chronischer lymphatischer Leukämie (CLL) zugelassen. Die im Labor nachzuweisenden Biomarker sind in diesem Fall eine 17p-Deletion oder eine Mutation des TP53-Gens. Venetoclax hemmt das anti-apoptotische B-Zell-Lymphom-2-Protein und aktiviert so indirekt den programmierten Zelltod in Tumorzellen, die das BCL-2-Gen überexprimieren.
Zwischen September 2017 und April 2018 wurden drei potente Mittel gegen akute Leukämien zugelassen. Bei der akuten myeloischen Leukämie (AML) wirkt der Tyrosinkinase-Inhibitor Midostaurin nur, wenn der Zytokinrezeptor FTL-3 hochreguliert und durch Mutation daueraktiviert ist. Das Immunkonjugat Gemtuzumab Ozogamicin zerstört gezielt Blasten mit einer Überexpression von CD33. Ein Immunkonjugat ist auch Inotuzumab Ozogamicin, das sich bei der ALL gegen Zellen mit CD22-Überexpression richtet.
In beiden Fällen besteht der Wirkstoff aus einem gegen das tumorspezifische Zielantigen gerichteten Antikörper und einem bakteriellen Toxin. CD33 und CD22 sind Zelladhäsionsmoleküle aus der SIGLEC-Glykoprotein-Familie, die auf der Oberfläche unreifer myeloischer bzw. lymphatischer Zellen exprimiert werden. Wenn der Antikörper des Immunkonjugats daran bindet, wird der Komplex internalisiert und das Toxin innerhalb der Zelle freigesetzt. Auf diese Weise ist das Medikament für gesunde Zellen relativ unschädlich.
Von den schon seit Jahren zugelassenen Medikamenten richten sich viele gegen eine bereits 1986 entdeckteTyrosinkinase, die vom BCR-ABL-Fusionsgen („Philadelphia-Chromosom“) kodiert wird. Diese Mutation ist bei fast allen Patienten mit CML sowie einem Teil der ALL-Patienten zu finden und lässt sich molekulardiagnostisch mit PCR und FISH nachweisen (siehe S. 189 und 191).
Andere Verfahren
Neben der Molekularbiologie bleiben herkömmliche Laborverfahren weiterhin essenziell für die Diagnostik von Leukämien und Lymphomen, allen voran natürlich die Mikroskopie von Blut- und Knochenmarkausstrichen (siehe Anzeige links). Speziell beim Multiplen Myelom basieren Diagnose und Prognose auf dem elektrophoretischen Nachweis der Immunglobulinvermehrung, der Immunfixation und der Bestimmung freier Leichtketten in Blut und Urin. Diverse Geräte für die Gel- und Kapillarelektrophorese werden auf der nächsten Doppelseite vorgestellt; eine ausführliche Beschreibung des Krankheitsbilds findet sich ab S. 200
Interdisziplinäre Zusammenarbeit
Ein Labor alleine wird heute kaum noch alle notwendigen Leistungen für die Leukämie- und Lymphomdiagnostik erbringen können. Es gilt vielmehr, räumliche und fachliche Grenzen zu überwinden. Das Zusammenspiel der hier genannten Methoden zur Erstellung des Gesamtbildes einer Erkrankung und zur Optimierung der Therapie gelingt nur durch enge Kooperation der beteiligten Labore und unter Bewertung der Ergebnisse durch Hämatologen, Labormediziner, Zytogenetiker und Molekularbiologen. Dazu kommen die Bioinformatiker, wenn es um die Auswertung sehr großer Datenmengen aus der Sequenzierung von Genpanels und ganzen Exomen oder Genomen geht.
Über aller „molekularen Euphorie“ darf aber nicht vergessen werden, dass es letztlich der Kliniker ist, der die Therapie bestimmt, weil er den Patienten kennt. Und auch die klassische Labordiagnostik bleibt unverzichtbar – insbesondere für die Verlaufskontrolle und die Bewertung der von der Erkrankung betroffenen Organsysteme.
Prof. Dr. Georg Hoffmann, Dr. Gabriele Egert
Mitglieder der Redaktion
Über Trillium Marktübersichten
Der Trillium-Verlag veröffentlicht regelmäßig Marktübersichten über innovative Entwicklungen und Produkte in der Medizin. Dabei fokussieren wir uns auf bewährte und innovative Testverfahren und -systeme aus dem gesamten Spektrum der In-vitro-Diagnostik (Labormedizin, Mikrobiologie, Transfusionsmedizin, Humangenetik, Pathologie und IT). Die Übersichten werden regelmäßig aktualisiert.
Hinweis
Die Sortierung der Anbieter erfolgt in tabellarischen Übersichten und virtuellen Ausstellungsräumen alphabetisch. Die Logos der teilnehmenden Unternehmen werden hingegen randomisiert ausgespielt.
Haftungsausschluss
Sämtliche Marktübersichten (Tabellen, Produktübersichten, virtuelle Industriestände) basieren auf Herstellerangaben und erheben keinen Anspruch auf Vollständigkeit und Richtigkeit; die Teilnahme ist kostenpflichtig. Wir weisen Sie im i. S. d. Bayerischen Pressegesetzes Artikel 9 ausdrücklich darauf hin, dass die Inhalte der virtuellen Industriestände werbend sind.






