DGHO 2016: Aus der Werkstatt der Hämatologen
Im Jahr 2016 wurde eine revidierte Fassung der WHO-Klassifikation myeloider Neoplasien und akuter Leukämien publiziert [1], in der die Differenzierung der Krankheitsbilder weiter voranschreitet – überwiegend aufgrund von Biomarkern, die vor allem durch Genexpressions- und Sequenzanalysen gefunden wurden. Diese Schärfung der diagnostischen Kriterien verbessert die Prognoseabschätzung, aber die Aufklärung der molekularen Grundlagen kann vor allem auch neue Zielstrukturen für Therapien identifizieren.
So haben sich bei der akuten myeloischen Leukämie (AML) mit einer internen Tandem-Duplikation (ITD) im Flt3-Rezeptor, die mit einer schlechten Prognose einhergeht, neue therapeutische Optionen ergeben. Zum einen hat sich gezeigt, dass die Zugabe des Flt3-Inhibitors Midostaurin zur Induktionstherapie das Gesamtüberleben dieser Patienten signifikant verlängern kann [2], aber darüber hinaus lässt sich auch die konventionelle Chemotherapie noch optimieren, so Richard Schlenk, Ulm: Bei Patienten mit Flt3-ITD, nicht aber bei denen mit dem Wildtyp des Gens kann man durch Erhöhung der Daunorubicin-Dosis in der Induktionsbehandlung von 60 auf 90 mg/m2 das Mortalitätsrisiko um ein Drittel reduzieren (Hazard Ratio 0,65; [3]).
In einer großen deutsch-österreichischen Phase-III-Studie mit 1.100 AML-Patienten (keine akute Promyelozyten-Leukämie) deutete sich außerdem an, dass die Zugabe von All-trans-Retinsäure (ATRA) zur Chemotherapie bei Patienten mit NPM1-Mutation das Ansprechen und das Gesamtüberleben positiv beeinflussen könnte – nicht in der Intention-to-treat-, aber in der Per-protocol-Analyse [4].
Quantifizierung der minimalen Resterkrankung bei der ALL
Das Monitoring der minimalen Resterkrankung (MRD) hat sich bei der akuten lymphatischen Leukämie (ALL) von Erwachsenen ebenso wie von Kindern in der Praxis eingebürgert, weil man daran bei der Erstlinien-Therapie sehr gut die Prognose abschätzen kann und hierdurch über ein wichtiges Element zur Therapiesteuerung verfügt. Goldstandards für die MRD-Messung sind derzeit die Allel-spezifische quantitative Real-time-Polymerase-Kettenreaktion (RQ-PCR) klonaler Rearrangements von Immunglobulin- (Ig) und T-Zell-Rezeptor(TCR)-Genen sowie die Mehrfarben-Durchflusszytometrie. Beide haben ihre Schwächen und Limitationen, die man versucht, durch Weiterentwicklungen zumindest teilweise zu umgehen, so Monika Brüggemann, Kiel:
Das EuroFlow-Konsortium arbeitet an neuen Hochdurchsatz-Konzepten für die Durchflusszytometrie („Next-Generation-Durchflusszytometrie“), die auf der Integration multidimensionaler Datenanalyse-Techniken basieren. Dabei ist es gelungen, durch geschickte Kombination von Antikörpern und Farbstoffen die gesamte Entwicklung der B-Vorläuferzellen im Knochenmark nachzuzeichnen. Bei einem konkreten Patienten lässt sich dadurch das Ausmaß der immunphänotypischen Abweichung der leukämischen Zellen von der normalen B-Zell-Entwicklung darstellen [5]. Mit standardisierten Prozessen, die auch die Vorbereitung der Zellproben einschließen, lassen sich höhere Sensitivitäten als bisher (d. h. < 10-4) erreichen.
Die Droplet Digital PCR (ddPCR) ist eine Weiterentwicklung, bei der Reagenzien und Probe in tausende winziger Tröpfchen aufgeteilt und daran anschließend eine Endpunkt-PCR durchgeführt wird. Durch simples Zählen der Tropfen mit positivem PCR-Produkt (kenntlich durch Fluoreszenz-Färbung) erhält man ein digitales Readout und damit eine absolute Quantifizierung. Die Anforderungen an die interne Standardisierung reduzieren sich dadurch. Hier stehen noch umfangreiche Ringversuche aus, um die klinische Zuverlässigkeit der Methode zur MRD-Quantifizierung zu bestätigen.
Beim Next Generating Sequencing von Ig/TCR-Rearrangements wird zunächst eine Multiplex-PCR mit Primern für V-, D- und J-Abschnitte verwendet, um alle potenziellen Rearrangements in einer Probe zu amplifizieren und zu sequenzieren. Dadurch vermeidet man die mühsame Entwicklung Patienten-spezifischer Assays, so Frau Brüggemann. Überdies ist, weil man anschließend auch noch tiefer sequenzieren kann, das Ergebnis spezifischer und sensitiver als mit einer RQ-PCR. Standardisierung, Validierung und Qualitätskontrolle des Ansatzes werden derzeit im EuroClonality NGS Network vorangetrieben.
CML: Ziel ist die therapiefreie Remission
Die MRD-Bestimmung wurde zuerst bei der chronischen myeloischen Leukämie (CML) eingeführt, um den Therapieerfolg unter Tyrosinkinaseinhibitoren zu kontrollieren. Der hochsensitive Nachweis von BCR-ABL-Transkripten mittels PCR im Blut ist neben klinischen und hämatologischen Untersuchungen von Blut und Knochenmark sowie dem zytogenetischen Nachweis leukämischer Zellen heute Standard bei der Betreuung von CML-Patienten. Zusätzliche Bedeutung gewinnt er durch die derzeitigen Bestrebungen, bei Patienten in tiefer Remission zunächst in kontrollierten Studien die Therapie versuchsweise abzusetzen.
Bisher sind zur Therapie der CML fünf Tyrosinkinaseinhibitoren zugelassen, so Thoralf Lange, Weißenfels, drei davon für die Erstlinientherapie. Ein optimales Ansprechen, d. h. eine möglichst tiefe molekulare Remission ist das Hauptziel der Therapie, und 15 Jahre nach der Einführung des ersten Inhibitors Imatinib ist ein Absetzen der Behandlung nach Erreichen einer solchen tiefen Remission zu einem weiteren Anliegen geworden, das auch den Wünschen vieler Patienten entspricht. Erforderlich ist dafür zunächst eine zuverlässige, reproduzierbare Messung der minimalen Resterkrankung, d. h. der Anzahl an BCR-ABL-Kopien im peripheren Blut. In den Studien, in denen das Absetzen der Therapie erprobt wird, werden unterschiedliche Voraussetzungen für die Qualität der bestehenden molekularen Remission (MR) verlangt: ENESTfreedom und ENESTop etwa fordern über mindestens ein Jahr eine BCR-ABL-Konzentration von höchstens 0,0032% der Ausgangswerte nach dem Internationalen Standard, entsprechend einer MR4,5, während in ENESTgoal und ENESTpath eine MR4,0, d.h. BCR-ABL-Werte von unter 0,01% über ein oder zwei Jahre als ausreichend angesehen werden. Um in der EURO-SKI-Studie die Therapie mit einem beliebigen Inhibitor absetzen zu können, müssen die Patienten über mindestens ein Jahr eine MR4,0 aufgewiesen haben.
Die bisherigen Ergebnisse dieser Strategie veranschaulichte Lange am Beispiel der ENESTfreedom-Studie, in der die 190 teilnehmenden Patienten vor dem Absetzen median etwa dreieinhalb Jahre lang Nilotinib eingenommen hatten und sich darunter median eineinhalb Jahre lang in einer MR4,5 befunden hatten. Nach einer medianen Nachbeobachtungszeit von 49,4 Monaten nach Absetzen der Behandlung waren 98 der 190 Patienten (51,6%) weiterhin mindestens in einer guten molekularen Remission (MMR, d. h. BCR-ABL ≤ 0,1%). 86 Patienten, die dieses Ziel nicht erreichten, erhielten wieder Nilotinib, und von ihnen erreichten 85 binnen kurzem wieder eine MMR und 76 sogar eine MR4,5. In der EURO-SKI-Studie war der Anteil an Patienten, die 36 Monate nach Absetzen der Therapie weiterhin in guter molekularer Remission waren, mit 49% ähnlich hoch.
Man kann also damit rechnen, so Lange, dass ungefähr die Hälfte der Patienten, die unter einem Tyrosinkinaseinhibitor für ein bis zwei Jahre in einer tiefen molekularen Remission gewesen sind, auch nach Absetzen des Inhibitors in ausreichender Remission bleiben. Nahezu alle Rezidive treten nämlich innerhalb des ersten Jahres ein, danach stabilisieren sich die Kurven auf einem Plateau. Genauso wichtig: Patienten, denen es nicht gelingt, die tiefe Remission zu halten, sprechen zuverlässig wieder auf die Therapie an.
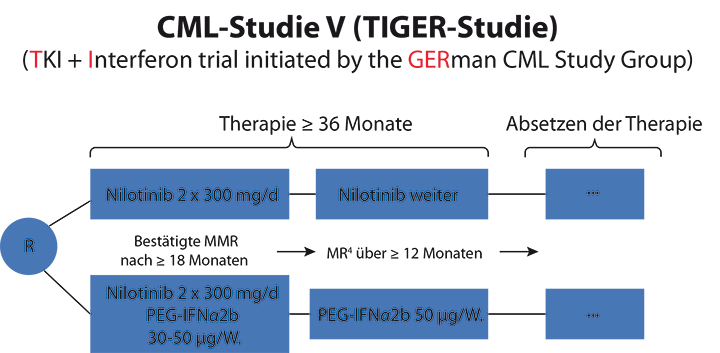
Von den weiteren CML-Studien, die derzeit in Deutschland laufen, hob Lange vor allem die CML-V-Studie (TIGER) hervor (Abb.1), in der ein besonderes Konzept überprüft werden soll [6]: Die Patienten werden randomisiert: In einem Arm erhalten sie über mindestens drei Jahren Nilotinib, das sie im Falle des Erreichens und Haltens einer MR4,0 für mindestens ein Jahr abzusetzen. Im anderen Arm bekommen sie zunächst eine optimierte Induktionstherapie mit einer Kombination aus Nilotinib und pegyliertem Interferon α und danach eine Erhaltungstherapie mit dem Interferon alleine; im Fall einer tiefen molekularen Remission kann auch hier die Therapie abgesetzt werden. Mit dem Einsatz des Zytokins verbindet man die Hoffnung auf eine Eradikation auch der leukämischen Stammzellen im Knochenmark und damit möglicherweise eine Heilung.
Daneben gibt es eine Reihe weiterer Studien zur Optimierung der Therapie mit den verschiedenen verfügbaren Tyrosinkinaseinhibitoren, zur Reduktion von Nebenwirkungen bei gleicher Wirksamkeit sowie zur Therapieoptimierung beim Auftreten von Resistenzen, etwa durch den Einsatz von Nilotinib in Kombination mit dem JAK-Inhibitor Ruxolitinib in der CoRNea-Studie [7].
Maligne Lymphome
Hodgkin-Lymphom: Neue Strategien zur Reduktion der Toxizität
Während die Diagnose eines Hodgkin-Lymphoms vor 50 Jahren noch einem Todesurteil gleichkam, liegen die 5-Jahres-Überlebensraten in den neueren Studien der Deutschen Hodgkin-Studiengruppe (GHSG) selbst für Patienten mit fortgeschrittener Erkrankung bei über 95%, so Peter Borchmann, Köln. Diese Ergebnisse sind wahrscheinlich kaum mehr zu verbessern, sehr wohl hingegen die Verträglichkeit der Therapie: Die aggressiven Chemotherapien und die Bestrahlungen, die vor allem in fortgeschrittenen Stadien zur Anwendung kommen, haben zahlreiche mögliche Spätfolgen, die vor allem für jüngere Patienten eine große Belastung darstellen. Grundsätzlich sieht Borchmann zwei Strategien, um diese Belastungen zu verringern:
Die Anwendung von Untersuchungen mit Positronenemissions- und Computertomografie (PET/CT) früh im Verlauf der Therapie, um diese im Falle eines guten Ansprechens zu deeskalieren, wird weiterhin geprüft. Es ist im Augenblick unklar, ob sie einen Nutzen für die Patienten bringen wird; mehrere Studien zu frühen Stadien sind bisher negativ verlaufen (EORTC H10, RAPID), bei der HD16-Studie der deutschen Studiengruppe ist die Rekrutierung abgeschlossen, bei der HD17-Studie zu intermediären Stadien läuft sie noch. In der HD18-Studie zu fortgeschrittenen Stadien hat sich gezeigt, dass ein positives zweites PET (PET2) kein Hochrisiko-Kollektiv definiert, so Borchmann. Ob bei PET2-negativen Patienten die Gabe von insgesamt viermal BEACOPPeskaliert ausreicht, wird sich in der Studie in etwa einem Jahr zeigen.
Die zweite vielversprechende Strategie ist der sukzessive Ersatz aggressiver Komponenten der Chemotherapie durch neue Substanzen wie das Antikörper-Wirkstoff-Konjugat Brentuximab Vedotin. In einer einarmigen Phase-II-Studie hat die GHSG bei Patienten mit fortgeschrittenem Hodgkin-Lymphom in der Erstlinientherapie das BEACOPP- (Bleomycin, Etoposid, Doxorubicin, Cyclophosphamid, Vincristin, Procarbazin und Prednison) durch das BrECADD-Protokoll (Brentuximab Vedotin, Etoposid, Doxorubicin, Dacarbazin und Dexamethason) ersetzt. Die ersten Ergebnisse sind vielversprechend, so Borchmann: Beim primären Endpunkt der Komplettremissionsrate nach Ende der Therapie hat BrECADD mit dem BEACOPP-Regime in der HD18-Studie gleichgezogen (in beiden Fällen 88%). Bei den hämatologischen Grad-3/4-Toxizitäten ist mit 80% versus 93% ein leichter, bei den nicht-hämatologischen Grad-3/4-Toxizitäten mit 2% versus 14,7% ein deutlicher Vorteil zu sehen. Im Juli 2016 ist die Phase-III-Studie HD21 gestartet, in der beide Regimes nun randomisiert miteinander verglichen werden sollen; bis Dezember sollen voraussichtlich alle teilnehmenden Zentren aktiviert sein [8].
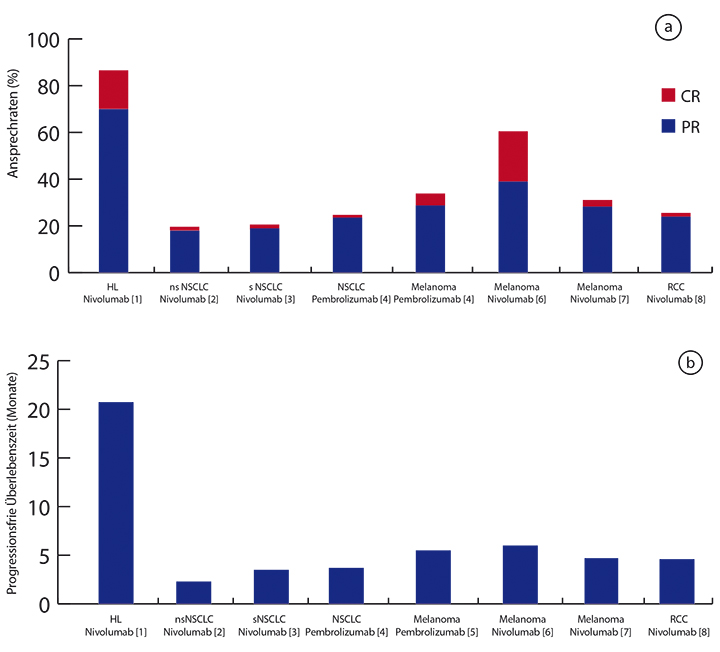
Checkpoint-Inhibitoren, vor allem PD-1-Antikörper wie Nivolumab und Pembrolizumab, haben bei soliden Tumoren in den letzten Jahren große Erfolge erzielt. Auch beim rezidivierten oder refraktären klassischen Hodgkin-Lymphom gibt es vielversprechende Daten mit hohen Ansprechraten und langen progressionsfreien Überlebenszeiten [9]. Interessanterweise sind die Ansprechraten beim Hodgkin-Lymphom sehr viel höher als bei epithelialen Tumoren und selbst beim Melanom (Abb. 2). Offen ist Borchmann zufolge, ob das Lymphom einfach empfindlicher gegen den Angriff der T-Lympohozyten ist oder ob hier bei sehr unterschiedlichen Krankheiten unterschiedliche Wirkmechanismen zum Tragen kommen. Die GHSG wird im Frühjahr 2017 mit der HD20-Studie ein Pilot-Projekt starten, in dem bei Patienten mit frühem Hodgkin-Lymphom mit ungünstiger Prognose ein PD-1-Antikörper mit einer Lymphozyten-depletierenden AVD-Chemotherapie kombiniert wird. Weitere Phase-II-Studien zu frühen und fortgeschrittenen Stadien sind in Planung.
Multiples Myelom: Früher mit der Therapie beginnen
Beim Multiplen Myelom haben sich in jüngster Zeit die Kriterien für den Therapiebeginn geändert, so Hermann Einsele, Würzburg: Galt bisher, dass neben nachgewiesenen Myelomzellen auch mindestens eines der CRAB-Kriterien (erhöhtes Kalzium, Nierenfunktionsstörung, Anämie, Knochenläsionen) erfüllt sein muss, um mit der antiproliferativen Behandlung zu starten, müssen jetzt Patienten ohne Endorganschäden unverzüglich behandelt werden, wenn sie mindestens 60% Plasmazellen im Knochenmark, eine freie Leichtketten-Ratio von ≥ 100 im Serum oder mehr als einen Herd im MRT aufweisen: Ansonsten droht ein Fortschreiten zum Myelom und ein Auftreten von Endorganschäden innerhalb von weniger als zwei Jahren.
Trotz Einführung zahlreicher neuer, hochwirksamer Medikamente in den letzten Jahren ist der Trend zu Innovationen beim Multiplen Myelom ungebrochen: So läuft in Würzburg derzeit eine Studie mit einem bispezifischen T-Zell-Engager-Antikörper (BiTE), der mit seinem einen Ende das BCMA-Antigen (B-Cell Maturation Antigen) auf der Myelomzellen und mit dem anderen das CD3-Antigen auf zytotoxischen T-Lymphozyten bindet und beide Zellen so in einen engen, für die Myelomzelle tödlichen Kontakt bringt. Ähnliche -Strategie richten sich gegen anderen Myelom-Antigene wie CD138, CD38 oder CS1.
ZNS-Lymphome
Neue Behandlungskonzepte für primäre ZNS-Lymphome stellte Gerald Illerhaus, Freibrug, vor. Grundsätzlich sollten diese Tumoren so intensiv wie möglich behandelt werden. In der Induktion hat sich in der Primärtherapie in einer Phase-II-Studie die Einführung einer konditionierenden Hochdosis-Chemotherapie mit nachfolgender autologer Stammzelltransplantation bewährt [10]: Nach der Transplantation stiegen die Komplettremissionsraten, die vorher bei unter 30% gelegen hatten, auf beinahe 80%. Eine Ganzhirnbestrahlung erhielten in dieser Studie nur mehr Patienten, die nach der Transplantation noch keine Komplettremission erzielt hatten.
In der europäischen Phase-II-Studie IELSG32 hat sich das MATRix-Protokoll bewährt, so Illerhaus, in dem zur Induktionstherapie aus Methotrexat und Cytarabin zusätzlich Thiotepa und Rituximab eingeführt worden war [11]. In diesem Arm konnten zum einen mehr Therapiezyklen gegeben werden als in den beiden anderen Gruppen ohne Thiotepa bzw. ohne Thiotepa und Rituximab, zum anderen war hier auch die Ansprechrate mit 88% (davon 49% Komplettremissionen) am höchsten. Ähnliches gilt für die Prognose: Nach median 30 Monaten waren im MATRix-Arm 67% der Patienten progressionsfrei am Leben, im Arm ohne Thiotepa 52% und in dem Arm, der nur Methotrexat und Cytarabin erhalten hatte, lediglich 36%. Wenn Rezidive auftraten, dann in 97% der Fälle im Gehirn, nur bei zwei Patienten wurden extrakranielle Rezidive diagnostiziert. Eine Salvage-Therapie war in allen drei Gruppen gleich effektiv: 65% der Patienten sprachen darauf an.
MATRix ist damit als derzeit beste Induktionstherapie bei Patienten mit primären ZNS-Lymphomen im Alter von bis zu 70 Jahren bestätigt, so Illerhaus. Die Frage nach der besten Konsolidierungsbehandlung wurde in der gleichen Studie mit einer zweiten Randomisierung gestellt, der zufolge die Patienten, die auf die Induktion mit mindestens einer Krankheitsstabilisierung angesprochen haben, entweder eine Ganzhirnbestrahlung mit 36 Gy (± 9 Gy Boost) oder eine Hochdosistherapie mit BCNU und Thiotepa sowie eine autologe Transplantation mit peripheren Stammzellen erhalten. Die Ergebnisse liegen noch nicht vor.
In der Phase-III-Studie IELSG43 soll außerdem bei insgesamt 250 Patienten mit mindestens einer partiellen Remission nach vier Zyklen MATRix die autologe Transplantation mit einer Polychemotherapie aus zwei Zyklen DeVIC (Dexamethason, Ifosfamid, Etoposid und Carboplatin) verglichen werden. Derzeit rekrutieren 35 deutsche und 40 italienische sowie einige dänische und tschechische Zentren Patienten in diese Studie [12].
In der IELSG45- oder FIORELLA-Studie schließlich werden über 70-jährige Patienten eingeschlossen. Im A-Teil der Studie werden Patienten, die nach zwei Zyklen Rituximab/Hochdosis-Methotrexat/Procarbazin mindestens stabil sind, zwischen einer sechsmonatigen Konsolidierung mit Procarbazin und einer zweijährigen Behandlung mit dem Immunmodulator Lenalidomid randomisiert. In einem einarmigen B-Teil erhalten die Patienten, die für Hochdosis-Methotrexat nicht geeignet sind, nach einer Kombination aus Ganzhirnbestrahlung, Temozolomid und Rituximab zwölf Monate lang Temozolomid.
Josef Gulden
Literatur
1. Arber DA et al. Blood 2016; 127: 2391-405.
2. Stone RM et al. ASH 2015, Abstract #6.
3. Burnet AK et al. Blood 2016; 128: 449-52.
4. Schlenk RF et al. Ann Hematol 2016; 95: 1931-42.
5. van Dongen JJ et al. Blood 2015; 125: 3996-4009.
6. ClinicalTrials.gov: NCT01657604.
7. ClinicalTrials.gov: NCT02253277.
8. ClinicalTrials.gov: NCT02661503.
9. Ansell SM et al. N Engl J Med 2015; 372: 311-9.
10. Illerhaus G et al. Lancet Haematol 2016; 3: e388-97.
11. Ferreri AJ et al. Lancet Haematol 2016; 3: e217-27.
12. ClinTrials.gov: NCT02531841.

